Las leyes experimentales de los gases
En 1662, Robert Boyle
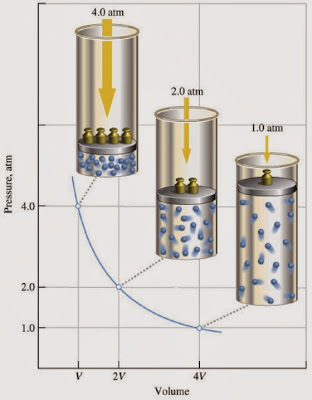
experimentaba con los gases. Para su experimento, utilizó un tubo de vidrio
curvo e introdujo aire en el extremo
corto cerrado. Luego agregó mercurio agregado (si se agregaba el doble de
mercurio, el aire se comprimía a la mitad de su volumen).
La conclusión de su trabajo
fue que el aumento de la presión que sufre una masa
de gas produce una disminución proporcional del volumen que este ocupa.
La expresión matemática de
esta ley, llamada ley de Boyle, es:
Como Boyle no había
especificado en qué condiciones de temperatura había trabajado, por ello, en
1676, el físico francés Edme Mariotte
repitió la experiencia y confirmó que este descubrimiento solo se cumplía a temperatura
constante. Así la ley de Boyle se
conoce como ley de Boyle y Mariotte.
En 1787, el científico
francés Jacques Charles retomó un trabajo anterior de Guillaume Amontons.
Realizó experiencias en que los gases se expandían en forma proporcional al
incremento de temperatura. Midió el grado de expansión y observó que por cada grado centígrado de
aumento de la temperatura, el volumen del gas aumentaba 1/273 con respecto al que
se encontraba a 0 ºC.
Descubrió que si la masa del
gas y la presión permanecen constantes, el volumen que ocupa una masa de gas es
directamente proporcional a su temperatura.
En 1802, Gay-Lussac
redescubrió la misma relación, por lo que esta ley es llamada ley de Charley y
Gay-Lussac.
Su representación matemática:
http://www.virtual.unal.edu.co/cursos/ciencias/gases/html/contenido_06.html
La ley de
Gay-Lussac
En 1805, enunció una nueva
ley llamada ley de Gay-Lussac.
Esta propone que la presión ejercida por la masa de
un gas aumenta en forma directamente proporcional al aumento de la temperatura
absoluta de dicho gas.
Las leyes experimentales y la teoría
cinéctico-molecular
- Ley de Boyle y Mariotte: Cuando se trabaja a temperatura constante, a medida que aumenta la presión de un gas, las partículas que lo componen se acercan mucho más unas a otras. Como consecuencia, el volumen del gas disminuye en forma proporcional al aumento de la presión.
- Ley de Charles y Gay-Lussac: Si se trabaja a presión constante, a medida que se incrementa la temperatura del gas aumenta la energía cinética y, como consecuencia, también lo hace la velocidad a medida de las partículas que lo componen. Así, las partículas se alejarán unas de otras y el volumen del gas aumentará.
- Ley de Gay-Lussac: Si se trabaja a volumen constante, a medida que aumenta la temperatura, aumentará la energía cinética. Este fenómeno producirá un aumento de la presión del gas.




No hay comentarios:
Publicar un comentario